Bài giảng môn Hóa học Lớp 9 - Bài 56: Ôn tập cuối năm
•a. Lấy mỗi chất một ít cho tác dụng với kim loại Zn chất nào có xuất hiện bọt khí là H2SO4 , chất không có hiện tượng là Na2SO4.
•c. Lấy mỗi chất một ít cho phản ứng với H2SO4 loãng dư, chất có bọt khí bay ra và tan hết đó là Na2CO3. Chất có bọt khí bay ra, đồng thời có kết tủa tạo thành là CaCO3.
•Na2CO3+ H2SO4 Na2SO4+ H2O + CO2
•CaCO3 + H2SO4 CaSO4 + H2O + CO2
•Bài tập 3:
• Hướng dẫn:
•- Phương pháp 1: Điện phân dung dịch muối ăn bảo hòa có màng ngăn (Phương trình phản ứng các em xem lại bài 26).
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng môn Hóa học Lớp 9 - Bài 56: Ôn tập cuối năm", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Bài giảng môn Hóa học Lớp 9 - Bài 56: Ôn tập cuối năm
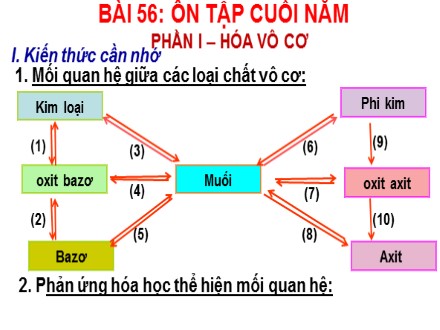
BÀI 56: ÔN TẬP CUỐI NĂM I. Kiến thức cần nhớ Bazơ oxit b azơ Axit oxit a xit Muối (1) (2) (3) (5) (6) (7) (8) (9) 1. Mối quan hệ giữa các loại chất vô cơ: Kim lo ại (4) (10) Phi kim 2. P hản ứng hóa học thể hiện mối quan hệ: PHẦN I – HÓA VÔ CƠ BAØI 56: OÂN TAÄP CUOÁI NAÊM. PHẦN I – HÓA VÔ CƠ: a. Kim loại Muối 2Fe + 3Cl 2 t 0 2FeCl 3 CuSO 4 + Fe FeSO 4 + Cu. b. Phi kim Muối S + 2Na t 0 Na 2 S 2NaBr + Cl 2 2NaCl + Br 2 BAØI 56: OÂN TAÄP CUOÁI NAÊM. PHẦN I – HÓA VÔ CƠ: c. Kim loại Ôxit bazơ Ca + O 2 t 0 2CaO CuO + C t 0 Cu + CO 2 d. Phi kim Ôxit axit 4P + 5O 2 t 0 2P 2 O 5 BAØI 56: OÂN TAÄP CUOÁI NAÊM. PHẦN I – HÓA VÔ CƠ: e. Oxit bazơ Muối CuO + 2HCl CuCl 2 + H 2 CaCO 3 t 0 CaO + CO 2 g. Oxit axit Muối CO 2 + 2NaOH Na 2 CO 3 + H 2 O K 2 CO 3 t 0 K 2 O + CO 2 BÀI 56: ÔN TẬP CUỐI NĂM I. Kiến thức cần nhớ II. Bài tập Bài tập 1 : HS đọc bài tập SGK PHẦN I – HÓA VÔ CƠ: BAØI 56: OÂN TAÄP CUOÁI NAÊM. PHẦN I – HÓA VÔ CƠ: a. Lấy mỗi chất một ít cho tác dụng với kim loại Zn chất nào có xuất hiện bọt khí là H 2 SO 4 , chất không có hiện tượng là Na 2 SO 4 . Zn + H 2 SO 4 ZnSO 4 + H 2 BAØI 56: OÂN TAÄP CUOÁI NAÊM. PHẦN I – HÓA VÔ CƠ: c. Lấy mỗi chất một ít cho phản ứng với H 2 SO 4 loãng dư, chất có bọt khí bay ra và tan hết đó là Na 2 CO 3 . Chất có bọt khí bay ra, đồng thời có kết tủa tạo thành là CaCO 3 . Na 2 CO 3 + H 2 SO 4 Na 2 SO 4 + H 2 O + CO 2 CaCO 3 + H 2 SO 4 CaSO 4 + H 2 O + CO 2 BAØI 56: OÂN TAÄP CUOÁI NAÊM. PHẦN I – HÓA VÔ CƠ: Bài tập 3: Hướng dẫn: - Phương pháp 1: Điện phân dung dịch muối ăn bảo hòa có màng ngăn (Phương trình phản ứng các em xem lại bài 26). BAØI 56: OÂN TAÄP CUOÁI NAÊM. PHẦN I – HÓA VÔ CƠ: Bài tập 3: - Phương pháp 2: Điều chế khí clo theo sơ đồ phản ứng sau: NaCl HCl Cl 2 (Hoặc: Dùng HCl đặc phản ứng với MnO 2 đun nhẹ cũng thu được Cl 2 ). Bài 56: ÔN TẬP CUỐI NĂM I. Kiến thức cần nhớ PHẦN II – HOÁ HỮU CƠ H 2) CH 2 = CH 2 1) H - C - H H 4) CH 3 - CH 2 - OH 5) CH 3 – COOH Metan Rượu etylic etilen axit axetic Chứa 4 liên kết đơn Chứa 1 liên kết đôi Chứa nhóm (- OH) Chứa nhóm ( -COOH) 1. Công thức cấu tạo: Bài 56: ÔN TẬP CUỐI NĂM I. Kiến thức cần nhớ PHẦN II – HOÁ HỮU CƠ 2. Các phản ứng quan trọng: - Phản ứng cháy của các hiđrôcacbon, rượu etylic - Phản ứng thế của metan, rượu etylic, axit axetic - Phản ứng cộng của etilen. - Phản ứng của axit axetic với kim loại, bazơ, oxit bazơ, muối - Phản ứng thuỷ phân của chất béo, gluxit. - Phản ứng este hoá, xà phòng hoá. 1. Công thức cấu tạo: II. Bài tập Bài tập 1 : Hoàn thành các PTPƯ sau, ghi rõ điều kiện nếu có? Nhóm 1: 1) CH 4 + O 2 .. + H 2 O 2) C 2 H 6 O + O 2 CO 2 + .. Nhóm 3: 1) .. + Br 2 C 2 H 4 Br 2 2) (RCOO) 3 C 3 H 5 + H 2 O .. + .. Nhóm 2: 1) CH 3 COOH + C 2 H 5 OH .. + H 2 O 2) CH 3 COOH + Mg .. + H 2 Nhóm 4: 1) CH 3 COOH + NaOH .. + H 2 O 2) CH 3 COOH + .. CH 3 COONa + CO 2 + H 2 O Bài tập 1 : Hoàn thành các PTPƯ sau, ghi rõ điều kiện nếu có? Nhóm 1: 1) CH 4 + 2 O 2 CO 2 + 2 H 2 O 2) C 2 H 6 O + 3 O 2 2 CO 2 + 3 H 2 O Nhóm 3: 1) C 2 H 4 + Br 2 C 2 H 4 Br 2 2) (RCOO) 3 C 3 H 5 + 3 H 2 O 3RCOOH + C 3 H 5 (OH) 5 Nhóm 2: 1) CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O 2) 2 CH 3 COOH + Mg (CH 3 COO) 2 Mg + H 2 Nhóm 4: CH 3 COOH + NaOH CH 3 COONa + H 2 O 2) 2 CH 3 COOH + Na 2 CO 3 2 CH 3 COONa + CO 2 + H 2 O t o t o Axit, t o H 2 SO 4 đ , t o Bài tập 2: Lựa chọn thuốc thử phù hợp với hoá chất cần nhận biết bằng cách chọn số ở cột 1 ghép với chữ cái ở cột 2. Cột 1 Cột 2 Kết quả 1) Dd brom 2) Quỳ tím 3) Iot 4) Dd bạc nitrat trong amonic a) Metan b) Etilen c) Dd hồ tinh bột d) Dd glucozơ e) Dd axit axetic 1 – 2 – 3 – 4 – b e c d Bài tập 3 : Viết PTHH thực hiện dãy chuyển đổi sau: Tinh bột Glucozơ R ượu etylic Axit axetic E tyl axetat Rượu etylic (2) (3) (5) (1) (4) (-C 6 H 10 O 5 -) n + nH 2 O nC 6 H 12 O 6 (1) C 6 H 12 O 6 2C 2 H 5 OH + 2CO 2 (2) 2C 2 H 5 OH + 2O 2 2CH 3 COOH + 2H 2 O (3) CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 +H 2 O (4) CH 3 COOC 2 H 5 + NaOH C 2 H 5 OH + CH 3 COONa (5) Axit Rượu Nước H 2 SO 4 đ Men giấm 30-32 t o - Viết PTHH, lập tỉ lệ mol giữa các chất - Tìm số mol O 2 cần dùng Vo 2 - Tìm số mol CO 2 tạo thành Vco 2 - Tính n CH = V:22,4 4 Bài tập : Đốt cháy 11,2 lít khí metan. Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành. Biết rằng thể tích các khí đo ở đktc Câu 3 : Đốt cháy 11,2 lít khí metan. Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành. Biết rằng thể tích các khí đo ở đktc n CH = 11,2/ 22,4 = 0,5 mol Đáp án CH 4 + 2O 2 C O 2 + 2H 2 O t 0 1mol 2mol 1mol 0.5mol 1mol 0,5mol V O = 1x 22,4 = 22,4lít V C O = 0.5 x 22,4 = 11,2lít 4 2 2 Bài tập: Để đốt cháy 4,48 lít khí etilen cần phải dùng: a) Bao nhiêu lít oxi? b) Bao nhiêu lít không khí chứa 20% thể tích oxi? Biết thể tích các khí đo ở điều kiện tiêu chuẩn. B1: Chuyển chất bài cho m hoặc V thành số mol n +n = m : M ( mol) +n = V : 22,4 ( mol) B4: Tính m hoặc V của chất bài yêu cầu tính + Tính KL: m = n . M (g) + Tính TT: V =n . 22,4 (l) B3: Dựa vào phương trình hoá học tính số mol của chất ( mà đầu bài yêu cầu tính m hoặc V). Giải bài tập tính theo PTHH B2: Lập( Viết) phương trình hoá học a) Phương trình phản ứng cháy etien: C 2 H 4 + 3O 2 2CO 2 + 2H 2 O. Tỷ lệ: 1 mol : 3 mol : 2 mol : 2 mol Đề bài: 0,2 mol : 0,6 mol : 0,4 mol : 0,4 mol Theo pt n O2 = 3. n C 2 H 4 = 0,2 x 3 = 0,6 mol. V O 2 = 0,6 x 22,4 = 13,44 lít. b) Thể tích không khí = = 67,2 lít. Bài tập: Đốt cháy hoàn toàn 1,12 lít khí etilen. Hãy tính: a) thể tích khí oxi cần dùng. b) khối lượng khí cacbonic tạo thành. Biết các thể tích khí đo ở điều kiện tiêu chuẩn. KiÕn thøc cÇn nhí 1) Công thức cấu tạo: Metan, etilen, rượu etylic,axit axetic 2) Các PƯ quan trọng: PƯ cháy của các hiđrôcacbon, rượu etylic PƯ thế của metan PƯ cộng của rượu etylic PƯ của rượu etylic với axit axetic, với Na PƯ của axit axetic với kim loại, bazơ, oxit bazơ, muối PƯ thuỷ phân của chất béo, gluxit 3) Các ứng dụng của hợp chất hữu cơ đã học ( tự ôn tập) H¦íNg dÉn vÒ nhµ Nắm chắc phần kiến thức cần nhớ ( rèn kĩ năng viết các PTHH quan trọng) Làm các phần còn lại của bài 3,4,5,6,7/Sgk - 168 Giải - Số mol C 2 H 4 = V : 22,4 = 1,12 : 22,4 = 0,05 (mol) PTHH: 0,05 3.0,05 2.0,05 (mol) a) Thể tích khí O 2 (đktc) cần dùng = n . 22.4 = 0,15 . 22,4 = 3,36 (lít). b) Khối lượng khí CO 2 tạo thành = n . M = 0,1 . 44 = 4,4 (gam). Bài tập 4. Đốt cháy hoàn toàn 1,12 lít khí etilen. Hãy tính: a) thể tích khí oxi cần dùng. b) khối lượng khí cacbonic tạo thành. Biết các thể tích khí đo ở điều kiện tiêu chuẩn. 2CO 2 + 2H 2 O C 2 H 4 + 3O 2 t o
File đính kèm:
 bai_giang_mon_hoa_hoc_lop_9_bai_56_on_tap_cuoi_nam.ppt
bai_giang_mon_hoa_hoc_lop_9_bai_56_on_tap_cuoi_nam.ppt

